Задание 8
Повторяем теорию👇
Химические свойства металлов
1.
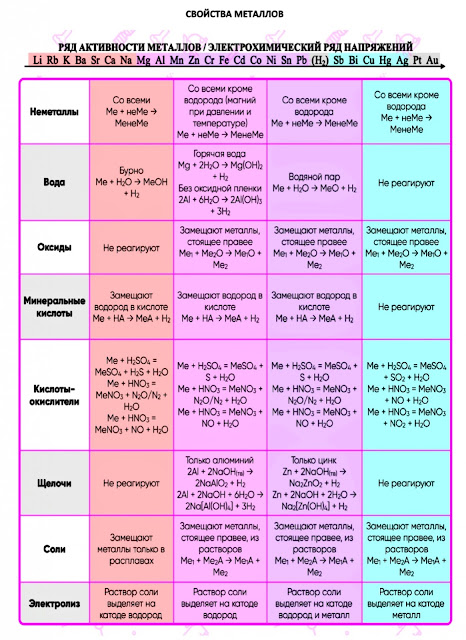
Металлы реагируют с неметаллами.
2.
Металлы, стоящие до водорода, реагируют с кислотами (кроме азотной и серной
конц.) с выделением водорода
3.
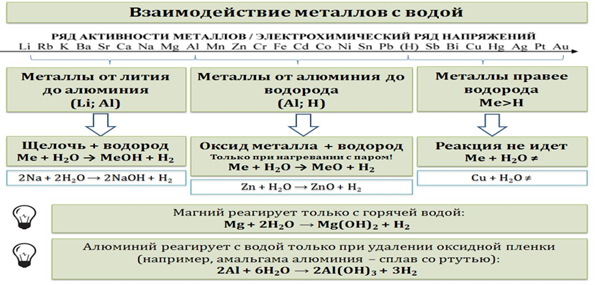
Активные металлы реагируют с водой с образованием щелочи и выделением водорода.
4.
Металлы средней активности реагируют с водой при нагревании, образуя оксид
металла и водород.
5.
Металлы, стоящие после водорода, с водой и растворами кислот (кроме азотной
и серной конц.) не реагируют
6.
Более активные металлы вытесняют менее активные из растворов их солей.
7.
Галогены реагируют с водой и раствором щелочи.
8.
Активные галогены (кроме фтора) вытесняют менее активные галогены из
растворов их солей.
9.
Галогены не реагируют с кислородом.
10.
Амфотерные металлы (Al, Be, Zn) реагируют с растворами щелочей и кислот.
11.
Магний реагирует с углекислым газом и оксидом кремния.
12.
Щелочные металлы (кроме лития) с кислородом образуют пероксиды.
Химические
свойства неметаллов
- Неметаллы реагируют с металлами и друг
с другом.
- Из неметаллов с водой реагируют только наиболее
активные – фтор, хлор, бром и йод.
- Фтор, хлор, бром и йод реагируют со щелочами по
той же схеме, что и с водой, только образуются не кислоты, а их соли, и
реакции не обратимы, а протекают до конца.
Химические свойства основных оксидов
Основные оксиды проявляют химическое
сродство к веществам кислой химической природы, им соответствуют основания.
- Взаимодействие
с водой
Na2O
+ H2O = 2NaOH,
Na2O + H2O = 2Na+ + 2OH-.
В данном случае образуется растворимое основание – щелочь; если металл образует нерастворимое основание, то его оксид не взаимодействует с водой, например, гидроксид кобальта Co(OH)2 – нерастворимое основание, и его оксид CoO с водой не взаимодействует.
- Взаимодействие
с кислотами
CuO + 2HCl
= CuCl2 + H2O,
CuO + 2H+ = Cu2+ + H2O.
В результате взаимодействия образуются соль и вода.
- Взаимодействие
с кислотными оксидами
3CaO + P2O5 =
Ca3(PO4)2.
В результате химической реакции образуется соль, которая
соответствует данному кислотному оксиду.
- Окислительно-восстановительные
реакции
4FeO + O2 =
2Fe2O3,
3CuO + 2NH3 = 3Cu +
N2 + 3H2O.
Химические свойства кислотных оксидов
Кислотным оксидам соответствуют кислоты, их
также называют ангидридами. Кислотные оксиды образуют неметаллы и металлы в
высоких степенях окисления.
- Взаимодействие
с водой
SO3 +
H2O = H2SO4,
SO3 + H2O = 2H+ +
SO42-.
Ангидриды, которым соответствуют нерастворимые кислоты, с
водой не взаимодействуют, например, кремневая кислота H2SiO3 нерастворима
в воде, и оксид кремния SiO2 с водой не взаимодействует.
- Взаимодействие
со щелочами
CO2 +
2NaOH = Na2CO3 + H2O,
CO2 + 2OH- = CO32- +
H2O.
В результате взаимодействия образуется соль кислоты,
которой соответствует оксид, и вода.
- Взаимодействие
с основными оксидами
BaO + SO3 =
BaSO4.
В результате химической реакции образуется соль.
- Окислительно-восстановительные
реакции
SO2 +
2H2S = 3S + 2H2O.
Химические свойства амфотерных оксидов
Амфотерными называются оксиды, которые в
зависимости от условий проявляют кислотные и основные свойства.
- Как
основные оксиды взаимодействуют с кислотами
Al2O3 + 3H2SO4 =
Al2(SO4)3 + 3H2O,
Al2O3 + 6H+ =
2Al3+ + 3H2O.
- Как
кислотные оксиды взаимодействуют со щелочами
В растворе
образуется комплексное соединение – тетрагидроксоалюминат натрия:
Al2O3 +
2NaOH + 3H2O = 2Na[Al(OH)4],
Al2O3 +
2OH- + 3H2O = 2[Al(OH)4]-.
При сплавлении образуется соль – алюминат натрия:
Al2O3 + 2NaOH = 2NaAlO2 +
H2O.
- Взаимодействие
с основными оксидами
Al2O3 +
Na2O = 2NaAlO2.
- Взаимодействие
с солями слабых и летучих кислот
Al2O3 + Na2CO3 =
2NaAlO2 + CO2,
Al2O3 + Na2SiO3 = 2NaAlO2 + SiO2.



Комментариев нет:
Отправить комментарий